プラズマローゲンが脳をまもる

九州大学名誉教授藤野武彦先生が提唱されている脳疲労仮説によれば、プラズマローゲンは酸化ストレスや神経炎症**といったさまざまな攻撃から脳を守るために平素から体内で合成されているのですが、脳が慢性的に過剰な攻撃にさらされるとプラズマローゲンが不足し、脳が疲労してしまいます。その結果、正常な神経機能を発揮できなくなり認知症、うつ病、不眠など、さらには身体の不調まで発症してくると考えられるのです。
脳が疲労してしまう前に、自前ではまかない切れなくなったプラズマローゲンをサプリメントとして補充することの有効性を示す科学的証拠が、現在ますます集まりつつあります。
*リン脂質とは、複合脂質の1種で脂肪酸とアルコール以外にリン酸残基を含む、脂質のことですべての細胞は脂質二重膜からなりリン脂質はその主要成分です。
**神経炎症とは、脳内においてグリア細胞の活性化による種々のサイトカインや活性酸素などのフリーラジカルの産生が亢進した病態で、アルツハイマー病を始め多くの神経変性疾患で観察されます。
クリニックにはこの他にもプラズマローゲンに関するパンフレットおよび試供品をご用意しております。
ご質問、ご興味のある方はお気軽にご相談にお出でください。
プラズマローゲンにはどんな働きがあるの?
脳は、あたかもパソコンの半導体集積回路のように神経細胞から伸びた突起を配線とする無数の神経回路から成り立ち、その回路に電気信号を回すことで複雑な運動を成し遂げ、繊細な感覚を感じ、意識や記憶や思考といった高度の認知機能を発揮し、喜びや悲しみや怒りや恐れなどの感情を実感することができます。
この神経突起を何重にも密に取り囲んで絶縁体として働いている膜状構造物をミエリン(髄鞘)と呼びます。イメージとしては中心棒の周りにバームクーヘンが作られていく様子に似ています。ただ、それは導線を覆うビニール管のように神経突起全体を覆っているのではなく一定の間隔を開けており(この隙間をランビエ絞輪と呼びます)、この隙間でしか活動電位を発生させることができません。ゆえに、ミエリンで覆われた神経突起では活動電位はランビエ絞輪の部分のみを経由して飛び飛びに伝わります。このような現象を跳躍伝導と呼び、ミエリンの存在によって伝導速度の上昇が可能となります。つまり、神経回路の情報伝達が格段に速くなります。例えていうなら新幹線と各駅停車の違いです。さらに、ミエリンは単に跳躍伝導に寄与するだけでなく、神経細胞との間で緊密な相互作用を通してさまざまな神経機能を調節しています。
このとても重要なミエリンは脂質に富んだ構造物でありその主要成分がプラズマローゲンなのです。ですから、プラズマローゲンが不足するとミエリンが正しく作られず脳が十分に機能を発揮できなくなるわけです。実際、ヒトでプラズマローゲンの合成に必要な酵素を遺伝的に欠損すると、肢根型点状軟骨異形成症という病気になることが知られています。この病気ではプラズマローゲンを合成できないために、関節点状石灰化、精神運動発達遅滞、白内障、末梢神経障害などを発症しますが、ミエリン形成異常が報告されています(1−3)。
プラズマローゲンは細胞の中でペルオキシソームおよび小胞体という細胞内小器官に局在する酵素により全7段階を経て合成されます。合成されたプラズマローゲンは細胞膜(とくにリピッドラフトに濃縮されて存在する)、ミトコンドリア、小胞体、エンドソームなどに分布します。プラズマローゲンは、ミエリンで機能する以外にも抗酸化作用、神経炎症の制御、神経細胞死の抑制、生体膜の流動性の調節、多価不飽和脂肪酸(EPAやDHAなど)の貯蔵とセカンドメッセンジャーの放出、コレステロール代謝の調節など多くの重要な生理機能を持つと想定されています。このように、プラズマローゲンは多面的な役割を演じて脳を老化や認知症から護っているのです。
プラズマローゲンについてもっと詳しく知りたい方は『プラズマローゲンを詳しく知りたい人のために』をぜひご覧下さい。
1. Braverman N. E. and Moser A. B. Biochim. Biophys. Acta. 1822 (2012) 1442-1452.
2. Sztriha L. et al. Dev. Med. Child Neurol. 42 (2000) 492-495.
3. Bams-Mengerink A. M. et al. Neurology 66 (2006) 798-803.
プラズマローゲンを詳しく知りたい人のために−1
プラズマローゲンとは

プラズマローゲンと言われても皆さんの大部分の方は初めて耳にする言葉だと思います。プラズマローゲンとはいったい何か、をはじめに説明しましょう。
プラズマローゲンはグリセロリン脂質と呼ばれる脂質の1種であり、細胞を構成する生体膜(脂質二重膜)の主要成分の1つです。ヒトでは全身のリン脂質の約18%がプラズマローゲンであると推定されています。生体膜を作れないとそもそも生物は存在できませんから、プラズマローゲンは非常に大切な物質です。
プラズマローゲンは脳、心臓、骨格筋に特に多く含まれ、リンパ球やマクロファージなどの白血球にもたくさん存在します。さらに精子にも豊富です。ところが、酸化ストレス、炎症、感染や外傷、神経変性、老化といった種々のストレスにさらされるとプラズマローゲンが減少します。たとえば、健康なヒトの脳では学習と記憶に関係の深い海馬や前頭葉にはプラズマローゲンがたくさん含まれていますが(海馬の総リン脂質の約30%がプラズマローゲンです)、アルツハイマー病患者さんでは対照群に比べてプラズマローゲンが有意に減少していることが知られています(1)。血液中のプラズマローゲンも減少しており、その減少の程度と認知症の重症度が相関することも報告されています(2)。したがって、プラズマローゲンをサプリメントとして外から体内に補うのは、人工物を摂取するのではなく、もともと自分自身の身体に備わっていたものが不足してしまったのでそれを補充するということです。
実際に、ホタテ由来プラズマローゲンをサプリメントとして軽度認知障害(MCI)やアルツハイマー病患者さんに6ヶ月間経口摂取していただきその効果を調べる臨床試験が行われました。その結果、軽度アルツハイマー病患者さんのグループで記憶障害の有意な改善が認められ、とりわけ77歳以下の女性アルツハイマー病患者さんのサブグループでその効果が顕著でした。また、全例で重篤な副作用を認めませんでした(3)。
以下に詳しく説明するように、プラズマローゲンは様々な作用(神経炎症の抑制、ミエリンの形成促進・機能維持、あるいは神経細胞の発達・修復・再生)を通じて脳機能を改善し、アルツハイマー病などの認知症や正常老化に伴う認知機能低下の予防、改善効果を発揮することが可能です。これは現在、認知症治療薬として保険適応が認められているコリンエステラーゼ阻害薬やメマンチン(NMDA受容体阻害薬?)とは全く別の新しいメカニズムによるものです。皆様もぜひ、この新しい可能性をご自身で実感してみてください。
プラズマローゲンを詳しく知りたい人のために-2
プラズマローゲンの働き
プラズマローゲンの生理機能として抗酸化作用、膜流動性の調節、多価不飽和脂肪酸の貯蔵とセカンドメッセンジャーの生成・放出、ミエリンの形成促進・機能維持、コレステロール生合成の制御、神経炎症や神経細胞死の制御などこれまでにも多くの役割が示されて来ましたが、全貌はまだ明らかになっていません。それほど多面的な機能を持った生体にとってなくてはならない非常に重要な物質だと言えるでしょう。その中でも、①ミエリンの形成促進・機能維持と②神経炎症の制御はとりわけ注目に値しますので詳しく説明しましょう。
ミエリンの形成促進・機能維持

脳は、あたかもパソコンの半導体集積回路のように神経細胞から伸びた突起を配線とする無数の神経回路から成り立ち、その回路に電気信号を回すことで複雑な運動を成し遂げ、繊細な感覚を感じ、意識や記憶や思考といった高度の認知機能を発揮し、喜びや悲しみや怒りや恐れなどの感情を実感することができます。
この神経突起を何重にも密に取り囲んで絶縁体として働いている膜状構造物をミエリン(髄鞘)と呼びます。イメージとしては中心棒の周りにバームクーヘンが作られていく様子に似ています。ただ、それは導線を覆うビニール管のように神経突起全体を覆っているのではなく一定の間隔を開けており(この隙間をランビエ絞輪と呼びます)、この隙間でしか活動電位を発生させることができません。ゆえに、ミエリンで覆われた神経突起では活動電位はランビエ絞輪の部分のみを経由して飛び飛びに伝わります。このような現象を跳躍伝導と呼び、ミエリンの存在によって伝導速度の上昇が可能となります。つまり、神経回路の情報伝達が格段に速くなります。例えていうなら新幹線と各駅停車の違いです。さらに、ミエリンは単に跳躍伝導に寄与するだけでなく、神経軸索との緊密な相互作用を介してさまざまな神経精神機能を調節しています。
このとても重要なミエリンは脂質に富んだ構造物でありその主要成分がプラズマローゲンです。脳に含まれるプラズマローゲンの量はミエリン形成の程度と相関します。たとえば、ヒトが生まれて最初の1年間に複雑な神経ネットワークが作られていきますが、この間に大脳白質に含まれるプラズマローゲンの量はなんと8倍にもなります。ですから、プラズマローゲンが不足するとミエリンが正しく作られず、脳が十分に発達できずに機能を発揮できなくなるわけです。
実際、ヒトで遺伝子異常のために生まれつきプラズマローゲンを合成できないと、肢根型点状軟骨異形成症という病気になることが知られていますが、この患者さんではミエリン形成不全を生じます(4)。またプラズマローゲンを欠損させたモデルマウスの実験から、ペルオキシソーム病を呼ばれる一群の疾患で認められる超長鎖脂肪酸の蓄積によって引き起こされるミエリンの消失(脱髄)、神経軸索損傷、グリア細胞増殖といった種々の障害からプラズマローゲンが神経系を保護することが示唆されています(5)。さらに、末梢神経系においてミエリン形成を司るシュワン細胞の正常な発生と分化、ミエリン形成と維持にプラズマローゲンが必須であり、細胞内情報伝達の制御因子として働くことが証明されています(6)。したがって、プラズマローゲンを十分摂取することはミエリンを維持し脳を正常に働かせるためにとても重要なのです。
プラズマローゲンを詳しく知りたい人のために−3
プラズマローゲンの働き
神経炎症の制御

一般に神経炎症(neuroinflammation)とは、外来病原微生物による脳炎などの急性感染症や外傷、多発性硬化症や自己免疫関連脳炎などのある種の自己免疫疾患、アルツハイマー病やパーキンソン病などの神経変性疾患などの際に見られるグリア細胞の活性化を引き金に、神経細胞や白血球や血管系構成細胞など多様な細胞を巻き込んだ一連の複雑な生体反応を総称した言葉です。そこにはポジティブな側面とネガティブな側面があります。
中枢および末梢神経系に外的あるいは内的刺激が加わると、おそらく最初にミクログリアが活性化され増殖するとともに種々の炎症性サイトカイン(IL-1β, TNFα, IL-6など)や神経障害因子(ROSなど)を放出し、他の細胞と協働して障害された部位を清掃します。これは一面では組織を破壊することにもつながりますからこのままでは組織は壊れたままです。そこで他方では、活性化ミクログリアやそれにより二次的に活性化した他の細胞が種々の神経保護因子(TGFβ, BDNF,IGF-1など)を分泌し組織の修復、再生を促します。このように神経炎症は、プラスとマイナスの両面が微妙なバランスを保ちながら有害な刺激から神経系を護る生体反応ですが、そのバランスが崩れると好ましくない反応が進み病気が進行することもあります。
もちろん炎症反応は神経系に限った現象ではありませんが、神経炎症では関与する役者が多く反応が複雑なこと、そもそも神経系が司る生理機能が極めて精巧に調節されているので炎症反応の効果が時間的空間的に広範囲に及ぶことなどから、神経炎症は様々な神経・精神疾患に関わる病態の基盤としてとても注目を集めています。最近では、反復社会挫折ストレスによる抑うつ状態を示すモデルマウスにおいて、ミクログリアの自然免疫受容体TLR2/4を介する神経炎症が抑うつ状態を誘導することが明らかにされました(7)。ヒトのある種のうつ状態でも同様のメカニズムが働いていると推測されます。
ところで、アルツハイマー病の真の原因や病態はまだ解明されていない点が多いのですが、少なくともアミロイドβ(Aβ)の蓄積(過剰産生および排出障害)が関与していることは確かなようです。このAβの蓄積に神経炎症が密接に関係しています。たとえば、グラム陰性菌由来のエンドトキシンであるリポポリサッカライド(LPS)を動物に投与するというのが神経炎症を実験的に誘導する代表的な研究手法の1つですが、成熟マウスの腹腔内にLPSを投与すると脳内でグリア細胞の活性化やAβ蓄積が起こるとともに、海馬や前頭葉の内因性プラズマローゲンが減少することが明らかになりました。これには炎症刺激で細胞内に誘導されるNFκBという転写調節因子がプラズマローゲン合成酵素の1つであるGNPAT(後述)の発現を抑制することが関与しています。さらに、プラズマローゲンが減少すること自体が神経炎症を増幅させるのです(8)。ところが興味深いことに、LPSとプラズマローゲンを同時に投与すると、このグリア細胞の活性化やAβ蓄積が抑制されたのです(9)。これは逆に、プラズマローゲンがNFκBの核内移行を阻害する能力を持つことによるようです。すなわち、NFκBという炎症反応の主役とプラズマローゲンがお互いに抑制し合うという密接な関係にあるわけです。これは、プラズマローゲンが神経炎症の制御にいかに重要な役割を演じる物質であるかをまさに示していると言えるでしょう。実際にこのモデルマウスにプラズマローゲンを経口投与したところ認知症の改善が認められるのです(10)。
他方、プラズマローゲンは神経炎症を制御するのみならず、タンパクリン酸化酵素(AKT, ERK)の活性化を介してcAMP応答配列結合タンパク(CREB)を活性化し学習と記憶に関与したり、たとえば脳由来神経栄養因子(BDNF)の産生を促して神経細胞の発達、修復、再生に貢献したり、ミトコンドリア依存性経路による神経細胞死(アポトーシス)を抑制するといった役割も果たすことが示唆されています。したがって、プラズマローゲンを十分摂取することは有害な攻撃から脳を護り正常に働かせるためにとても重要なのです。
プラズマローゲンを詳しく知りたい人のために−4
プラズマローゲンの構造と生合成

最後に、今まで述べてきたプラズマローゲンの重要性をより深く理解していただくために、やや専門的になりますがプラズマローゲンの構造と生合成過程を簡単に説明します。少し複雑ですが興味のある方はぜひ読んで下さい。
プラズマローゲンの構造
プラズマローゲンは通常のグリセロリン脂質であるジアシル型とは異なる重要な特徴を持っています。図1を見て下さい。プラズマローゲンではグリセロール骨格の1番目(sn-1)にビニルエーテル結合(-O-CH=CH-)でつながれた脂肪族アルコールが入ります。そのためグリセロール骨格の2番目(sn-2)に入るアシル基が折れ曲がらず真っ直ぐに配向されるので隣り合うプラズマローゲンのアシル基同士が膜の中でより近接して存在することが可能になり、その結果、膜の流動性を下げることができます。また、(sn-1)のビニルエーテル結合(-O-CH=CH-)には炭素と2重結合した酸素(-CO-)が含まれないので親水性が高まり、隣り合うプラズマローゲンのグリセロール骨格の3番目(sn-3)に結合するヘッドグループ(Head group)間の水素結合を強化することができます。このような構造的特徴のおかげで、プラズマローゲンを大量に含むミエリンが安定になり神経軸索の周囲にコンパクトにしっかり接着することができると考えられます。
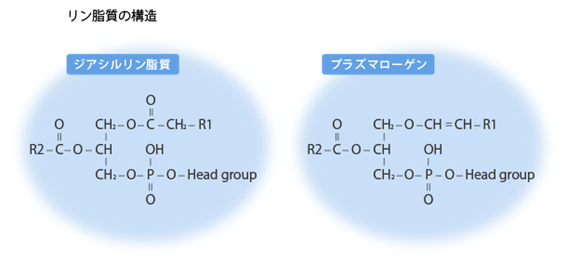
図1(レオロジー機能食品研究所のホームページより転載)
ビニルエーテル結合(-O-CH=CH-)が活性酸素に反応性が高いことから、プラズマローゲンには抗酸化作用があり、この酸化物が細胞に過酸化反応がさらに拡大するのを防ぎます。グリセロール骨格の2番目(sn-2)にAA(アラキドン酸)やEPA(エイコサペンタエン酸)やDHA(ドコサヘキサエン酸)などの多価不飽和脂肪酸を多く含み(11)、そこからプロスタグランジン、トロンボキサン、ロイコトリエンといった細胞内シグナル伝達にかかわるセカンドメッセンジャーを産生、放出します(図2参照)。EPAやDHAのn-3系多価不飽和脂肪酸からは主に抗炎症作用を持った物質が産生されますので、慢性的に酸化ストレスや炎症にさらされる脳ではEPAやDHAの需要が高まります。ところが、ヒトの脳ではこれらをほとんど合成できないので食事として外から十分摂取する必要があります。遊離あるいはトリグリセライド(中性脂肪)に結合したEPAやDHAよりもプラズマローゲンのようなリン脂質に結合したEPAやDHAの方が脳に取り込まれやすいことが知られています(12)。
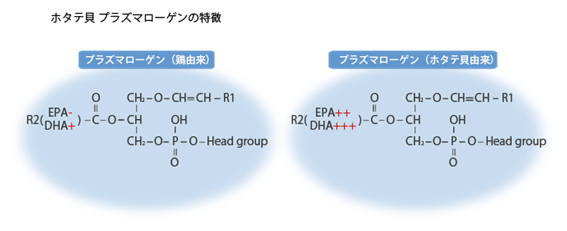
図2 ホタテプラズマローゲンは鶏プラズマローゲンに比べてDHAやEPAを多く貯蔵する(レオロジー機能食品研究所のホームページより一部改変)
プラズマローゲンの生合成
次にプラズマローゲンの生合成過程を見ておきましょう。プラズマローゲンはペルオキシソームと小胞体に局在する酵素により7段階の反応を経て合成されます。このうち合成の第1段階(ジヒドロキシアセトンリン酸から1-アシルジヒドロキシアセトンリン酸をつくる)を触媒する酵素(GNPAT)および第2段階(1-アシルジヒドロキシアセトンリン酸から1-アルキルジヒドロキシアセトンリン酸をつくる)を触媒する酵素(AGPS)が特に重要です。この最初の2段階の反応がペルオキシソームで行われ、その後小胞体に移動して残りの反応が進みます。小胞体で完成したプラズマローゲンはそこからさらに細胞膜やミトコンドリア膜にも運ばれ種々の機能を果たします。
GNPAT、AGPS、AGPSをペルオキシソームに運ぶために必要なタンパク質PEX7、さらにプラズマローゲンの合成に関わるその他のタンパク質2種類、合計5種類のタンパク質がヒトで生まれつき正常に機能しないと、すなわちプラズマローゲンを体内で正常に合成できないと、前述したように肢根型点状軟骨異形成症という病気になります。この病気は関節点状石灰化、精神運動発達遅滞、ミエリン形成異常、白内障などの症状を示します。現在、肢根型点状軟骨異形成症は1型から5型まで知られていますが、PEX7欠損が1型、GNPAT欠損が2型、AGPS欠損が3型に対応します。
参考文献
- Ginsberg L. et al. Brain Res. 698 (1-2) (1995) 223-226.
- Oma S. et al. Dement. Geriatr. Cogn. Disord. Extra. 2 (2012) 298-303.
- Fujino. T. et al. EBioMedicine 17 (2017) 199-205.
- Bams-Mengerink A.M. et al. Neurology 66 (2006) 798-803.
- Brites P. et al. Brain 132 (2009) 482-492.
- da Silva T.F. et al. J. Clin. Invest. (2014) 2560-2570.
- Nie X. et al. Neuron 99 (2018) 464-479.
- Hossain M.S. et al. J. Neurosci. 37 (2017) 4074-4092.
- Ifuku M. et al. Neuroinflammation 9 (2012) 197.
- Hossain M.S. et al. Biochem. Biophys. Res. Commun. 496 (2018) 1033-1039.
- Abe Y. et al. Biochim. Biophys. Acta. 1841 (2014) 610-619.
- Rossmeisl M. et al. PlosOne (2012) e38834.
ホタテ・プラズマローゲン
疲れた脳にはホタテ・プラズマローゲンが効果的
プラズマローゲンには多価不飽和脂肪酸が結合していますが、ホタテ・プラズマローゲンはアラキドン酸(AA)よりもエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)をずっと多く含むことが特徴です。EPAやDHAという名前はおそらく耳にされたことがあるでしょう。そう、イワシやサンマなどの魚油に豊富に含まれるサプリメントの定番ですね。アラキドン酸とEPAはどちらも強力な生理活性脂質エイコサノイドの前駆体ですが、アラキドン酸からは主に、不整脈を起こしたり、血管を収縮したり、炎症を促進する物質が産生される一方、EPAからはアラキドン酸の作用を抑制し、血管を拡張し、抗炎症作用を発揮する物質が産生されます。しかし人の脳ではEPAやDHAがほとんど合成されないので不足しやすく食餌として摂取しなければなりません。特に慢性的に酸化ストレスや炎症に暴露されて疲労した脳ではその摂取はとりわけ重要ですが、遊離したEPAやDHAよりもプラズマローゲンのようなリン脂質に結合したEPAやDHAのほうが脳に取り込まれやすいことが知られています。つまり、ホタテ・プラズマローゲンを摂取すると、プラズマローゲンとともにEPAやDHAも効率的に摂取できるのです。まさに一石二鳥ですね。
ホタテ・プラズマローゲン カプセル(1日量2粒あたり1,000μg配合)((株)ビーアンドエス・コーポレーション)
1日2回、朝食・夕食後に1粒ずつお飲み下さい。
| 価格 | 1箱あたり230mgX60粒(1ヶ月分) 8,000円(税抜) |
|---|
ミエリン形成がアルツハイマー病のキーポイント
〜ミエリン形成を維持して神経回路を活性化〜
最近、雑誌ネイチャーに画期的な論文が発表されています(Mathys, H. et al. Nature 570, 332-340, 2019)。アルツハイマー病の初期から後期に至る種々の段階の48人の患者さんにおいて、大脳前頭前野(Brodmann10)に存在する主要な中枢神経系細胞(興奮性ニューロン、抑制性ニューロン、アストロサイト、オリゴデンドロサイト、オリゴデンドロサイト前駆細胞、ミクログリア)を単一細胞ごとに(総計80,660個の細胞核)遺伝子発現を調べたところ、ミエリン形成過程に関与する遺伝子の発現がニューロンにおいてもグリアにおいても繰り返し掻き乱されていることが明らかにされ、ミエリン形成がアルツハイマー病の病態生理を考える上で非常に重要な役割を演じることが強く示唆されました。これまではアミロイド仮説やその傍流の諸説に則り、アミロイドβが何らかの原因で蓄積してオリゴマーや老人斑を形成し、それが(直接またはリン酸化タウの蓄積を介して)シナプスや神経細胞を障害するというストーリーが広く主張されてきましたが、一部の研究者はミエリン形成障害の関与を想定していました。今回の研究で、ミエリン形成に関わる過程の本質的重要性が改めて浮き彫りになりました。
ところで、ミエリン形成を促す方法の一つとして、生薬「陳皮」の働きと漢方治療が注目されています。陳皮の効能について以前から漢方専門家により着実に研究が進められており、陳皮に含まれる成分の中でとくにヘスペリジンとナリルチンという物質がミエリン再形成促進作用を持つことが実証されていますが、その他の成分にもたとえば神経栄養因子BDNFの産生増強やアミロイドβ神経毒性の抑制作用などが認められています。したがって陳皮の抗認知症効果は、陳皮に含まれる多くの成分が相互に関連しながら優れた薬理効果を発揮しているのでしょう。陳皮を含むエキス剤として人参養栄湯と抑肝散加陳皮半夏がよく知られていますので、当院ではプラズマローゲンに加えてこれらの漢方薬も一緒に使用しながら、アルツハイマー病や加齢に伴う認知機能低下に対してミエリン形成を促し神経回路を活性化する治療を試みています。